去年年底,中國科學院生物化學與細胞生物學研究所的周斌團隊與交通大學國際婦幼保健院的黃荷鳳團隊在Circulation期刊上發表了題為“In Vivo AAV-CRISPR/Cas9-mediated Gene Editing Ameliorates Atherosclerosis in Familial Hypercholesterolemia”的文章,發現利用AAV-CRISPR/Cas9系統對攜帶可導致家族性高膽固醇血癥(FH)的致病Ldlr突變小鼠進行LDLR基因校正,能夠部分地修復低密度脂蛋白受體(LDLR)表達并有效改善LDLR突變體中的動脈粥樣硬化,為FH患者的治療提供潛在的治療方法。
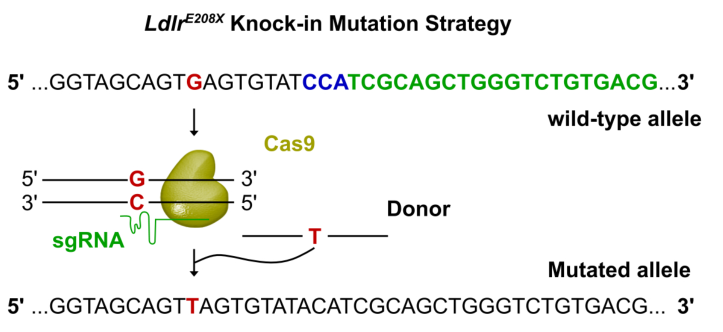
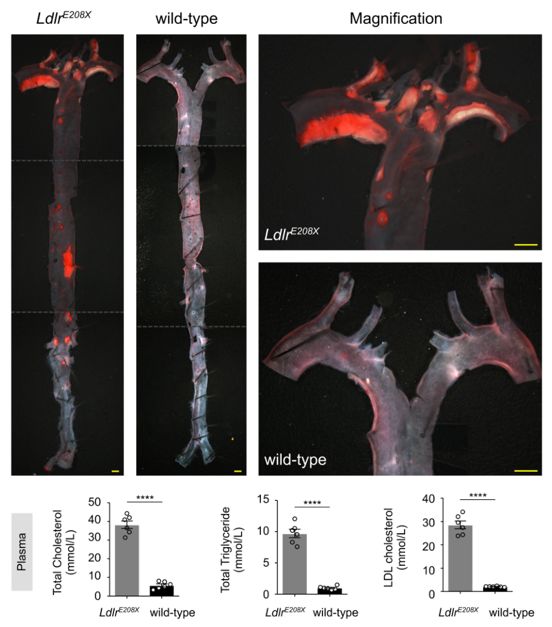
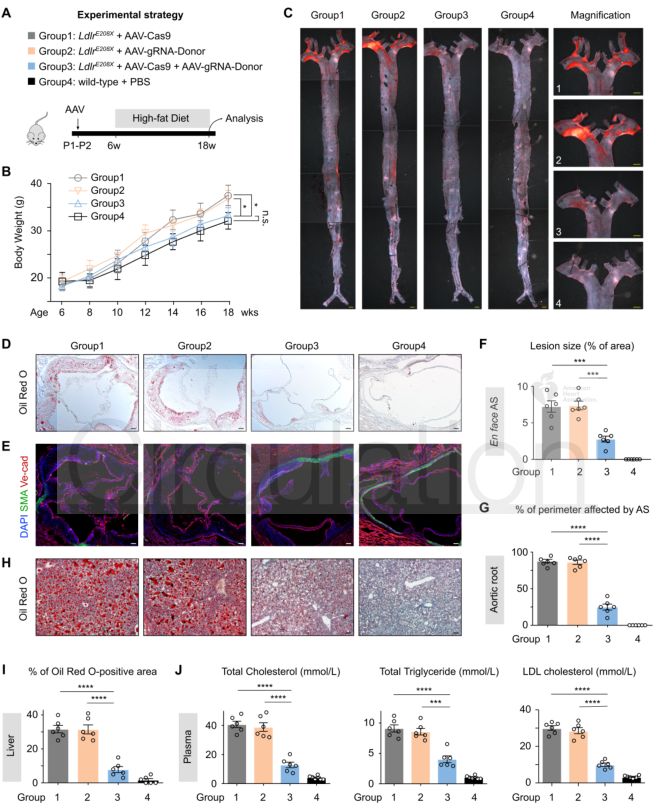
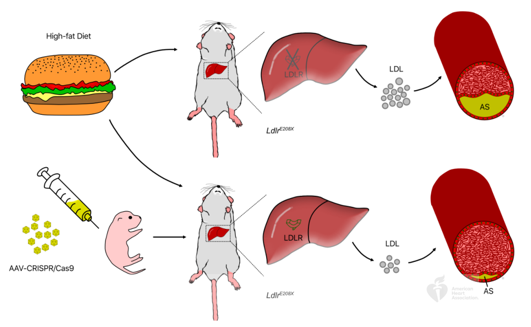
Innovation 創新點 1. 為人類家族性高膽固醇血癥發病機制的研究建立了一種新的模型:含E208X無義點突變的LdlrE208X小鼠。 2. 通過單次注射AAV-CRISPR/Cas9對LdlrE208X小鼠進行體內基因編輯,可以減少脂質積累并改善動脈粥樣硬化。 背景介紹 家族性高膽固醇血癥(FH)的特點是低密度脂蛋白膽固醇(LDL-C)水平顯著升高和過早發生心血管疾病。FH是一種常染色體顯性遺傳病,具有基因劑量效應,由編碼低密度脂蛋白受體(LDLR)、載脂蛋白B(APOB)或枯草溶菌素轉化酶9(PCSK9)的基因突變引起的。其中,90%的FH是由LDLR突變導致的。LDLR突變可導致功能性LDLR的表達水平降低,肝臟對血液循環中LDL-C的清除能力下降,進而使血液循環中的LDL-C過量,從而導致動脈粥樣硬化斑塊的發生和發展。動脈粥樣硬化的嚴重程度與肝組織中LDLR的表達水平和活性密切相關。 純合子FH(HoFH)的發病率約為百萬分之一,可在嬰幼兒時期就迅速發展為嚴重的動脈粥樣硬化和心血管疾病,并導致死亡。雜合子FH患者(HeFH)具有功能性LDLR蛋白,因此目前的FH藥物治療(例如MG-CoA還原酶抑制劑(他汀類))通常只對HeFH有效,而高強度他汀類藥物和PCSK9抑制劑對HoFH的治療效果非常有限。這些差異表明即使低水平的LDLR表達和活性也可以顯著影響FH的嚴重程度和發展速度。針對HoFH,現有的治療手段包括LDL血漿置換及肝移植等,費用昂貴且存在一定風險,因此繼續尋找和探索新的治療方法具有重要意義。 關于家族性高膽固醇血癥臨床特征及相關基因檢測的更多介紹,詳見(點擊查看原文): 成簇規律間隔的短回文重復序列(CRISPR)和其相關核酸內切酶(Cas)是近些年來發現和興起的一種基因編輯技術,以其高效性和簡便性廣泛應用于不同物種的細胞基因編輯、動物模型構建和致病基因治療等方面,極大地促進了生物學和醫學研究發展。腺相關病毒(AAV)由于其高安全性以及穩定長效表達,被視為最有前景的基因治療載體。利用AAV進行的基因治療目前已被批準用于80多種疾病,并已用于臨床試驗。利用基因治療人類遺傳疾病是近年來醫學生物領域的熱點課題。 本研究為了確定AAV介導的CRISPR/Cas9系統對體內體細胞進行基因編輯是否可治療由Ldlr突變引起的FH。 研究方法及結果 研究人員根據已在FH患者中發現的LDLR基因E207X無義突變(提前產生終止密碼子,導致LDLR蛋白無法正常表達),利用CRISPR/Cas9系統將其導入小鼠受精卵進行打靶(圖1),通過后續傳代交配,成功構建LdlrE208X小鼠(純合子),并通過基因測序、反轉錄PCR、Western blot和免疫熒光染色等方法進行了驗證。結果發現攜帶純合突變的LdlrE208X小鼠(n=6)經高脂膳食喂養后,肝臟中無LDLR蛋白表達,表現為嚴重的動脈粥樣硬化表型(圖2),與人類的HoFH患者表現類似。 圖1. LdlrE208X敲入小鼠的突變策略。 圖2. 高脂膳食喂養后LdlrE208X小鼠主動脈動脈粥樣硬化病變的油紅O染色圖像及血漿總膽固醇、總甘油三酯、低密度脂蛋白(LDL)膽固醇水平對比。 隨后利用AAV將CRISPR/Cas9系統(AAV-CRISPR/Cas9)送入LdlrE208X小鼠(n=6)體內,通過小向導RNA(sgRNA)引導Cas9蛋白至特定DNA位點后,利用同源重組修復(HDR)來矯正部分肝細胞的Ldlr突變,并部分恢復其LDLR蛋白的表達(n=6)。與對照組(n=6)相比,sgRNA的AAV-CRISPR/Cas9組(每組6只)的血清總膽固醇、總甘油三酯和LDL-C均顯著降低,且主動脈粥樣硬化斑塊更小,巨噬細胞浸潤程度更低,LdlrE208X小鼠肝臟脂肪蓄積得到有效降低(圖3和圖4)。同時CRISPR/Cas9系統的脫靶效應和一些免疫指標均顯示,成體小鼠體內并未發現明顯的脫靶及免疫排斥反應,支持了此次基因編輯治療的有效性和安全性。 圖3. AAV-CRISPR/Cas9治療后LdlrE208X小鼠中LDLR表達的部分恢復和動脈粥樣硬化的改善。 A. 腺相關病毒(AAV)注射、高脂飲食喂養及分析的實驗策略。B. 各組不同時期的體重。C. 主動脈動脈粥樣硬化病變的油紅O染色圖像。D. 小鼠主動脈根部油紅O染色圖像。E. 主動脈根部平滑肌肌動蛋白(SMA)和Ve-cad的免疫染色。F. 各組動脈粥樣硬化病變面積的量化。G. 各組動脈粥樣硬化(AS)對主動脈周長的影響。H. 肝切片油紅O染色圖像。I. 肝切片油紅O陽性區的定量。J. 小鼠血漿總膽固醇、總甘油三酯、低密度脂蛋白膽固醇水平對比。 圖4. AAV-CRISPR/Cas9治療后LdlrE208X小鼠的部分恢復及動脈粥樣硬化表型改善的示意圖。 以上結果表明,通過AAV-CRISPR/Cas9系統進行的體內基因編輯可能是一種有效的HoFH治療方法,同時可能有助于改善當前降脂藥物的療效。此外也證明CRISPR/Cas9技術可作為一種應用于人類遺傳病治療的潛在工具,但在進入臨床實驗前還必須進行更多研究測試(如大型動物試驗等)。 結論 本研究表明在體內用AAV-CRISPR/Cas9介導的Ldlr基因校正可部分恢復LDLR的表達,有效改善Ldlr突變小鼠的動脈粥樣硬化表型,為FH患者提供了一種潛在的治療方法。隨著全基因組測序成本的降低,對家庭成員和胎兒進行篩查將變得更加普遍。因此,在疾病進展的早期階段診斷FH,有可能實現通過基因校正進行早期治療。將來,AAV-CRISPR/Cas9系統可能用于校正遺傳性心血管病中的一些生殖細胞基因突變,從而改善甚至修復疾病。 【參考文獻】 Huan Zhao, et al. In Vivo AAV-CRISPR/Cas9-Mediated Gene Editing Ameliorates Atherosclerosis in Familial Hypercholesterolemia. Circulation. 2020, 141: 67-79.