

引言
急性髓性白血病(acute myeloid leukemia,AML)是一個高度異質性的疾病,對治療有不同的反應。雖然大多數新診斷的AML患者在接受強化治療后形態學完全緩解,但復發率仍然很高。下一代測序(Next-generation sequencing,NGS)技術幾乎在每個患者身上都能檢出微小殘留病變(minimal residual disease,MRD),但其在預測復發方面的臨床價值尚未確定。一項發表在NEJM的研究顯示,在AML患者完全緩解(complete remission, CR)期間基于靶向測序的MRD檢測與患者的復發和死亡風險增高相關。該研究納入482名18~65歲新診斷的AML患者,在初診時和CR期進行NGS基因突變組合檢測(54基因),探討NGS檢測在AML患者MRD檢測和復發預測方面的臨床應用價值。
初診時和完全緩解期間的AML基因突變分析
01
NGS檢測結果顯示,新診斷的482例患者中,430例(89.2%)至少攜帶一種突變,每個人平均攜帶2.9個突變,最常見的突變為NPM1、DNMT3A、FLT3和NRAS(圖1A)。430例患者初診和CR期的2次NGS檢測結果顯示,51.4%的患者在CR期突變持續存在,且突變等位基因頻率存在很大的差異(0.02%~47%,圖1B)。DTA(DNMT3A、TET2、ASXL1)突變最常見,頻率通常高于2.5%,與白血病幼稚細胞的比例不一致(<5%);反之,IDH1、IDH2、STAG2、TP53和其他基因突變偶有突變頻率高于2.5%的持續存在,這些基因突變頻率的改變與形態學CR狀態基本一致。DTA突變通常與年齡相關的克隆性造血相關,持續的DTA突變可能代表了非白血病克隆。在初診時同時存在DTA和非DTA突變的133例患者中,CR期非DTA突變一般被清除,但其中90例患者(67.7%)在CR期通常仍可檢測到DTA突變,該結果與CR期帶有DTA突變的殘余細胞代表非白血病克隆而非持續性惡性疾病的觀點一致。
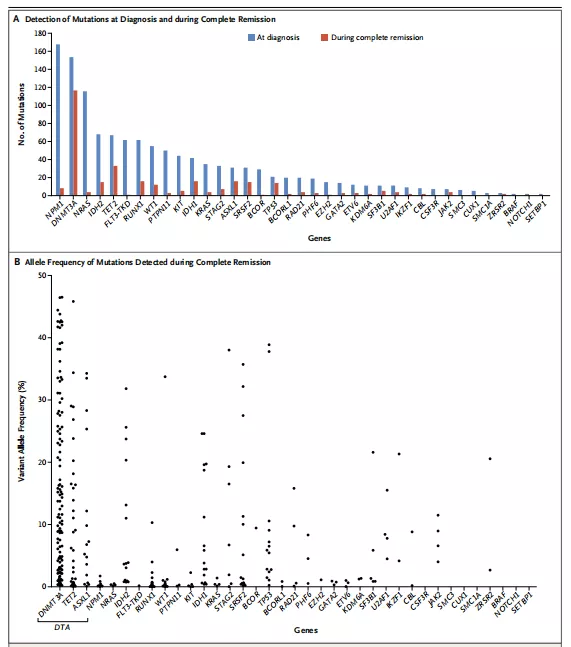
圖1初診和CR期的基因突變(A)以及CR期的突變等位基因頻率(B)
非DTA突變是AML患者預后評估的獨立指標
02
持續的DTA突變與4年的復發率沒有顯著的相關性。然而,在CR期持續存在DTA突變的患者中,同時持續存在非DTA突變對AML復發具有較高的預測價值(4年復發率,檢測到的為66.7%,未檢測到的 39.4%;P = 0.002),是預后評估的獨立指標(圖2A)。隨后,研究者評估了持續存在的非DTA突變與復發風險的關系,發現任何等位基因頻率的非DTA突變的持續存在都與AML的復發風險增加密切相關(4年復發率,檢測到的為55.7%,未檢測到的為34.6%;P=0.001),無復發生存率(4年無復發生存率56.7%,無復發生存率36.6%;P=0.006)和總生存率降低(4年總生存率,檢測到的65.3%,未檢測到43.7%;P=0.001)密切相關(圖2B)。
為了評估結果的可重復性,研究者對另一隊列進行非DNA突變與復發率、無復發生存率和總生存率關系的驗證,二者的結果一致(圖2B,2C)。在試驗組和驗證組的430名患者中,28.4%的患者在CR期檢測到持續存在的非DTA突變。
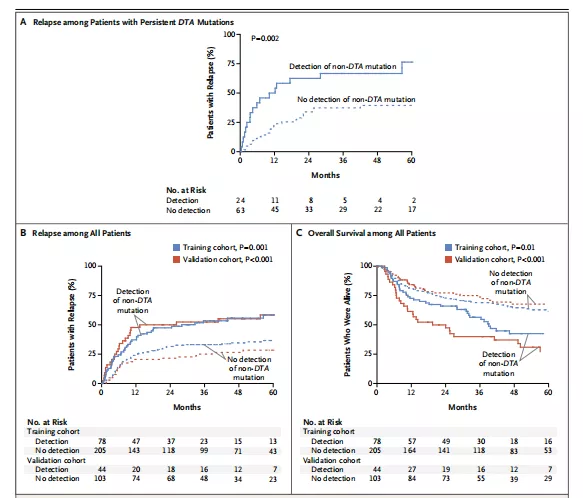
圖2 持續存在DTA突變患者的復發率(A),所有患者的復發率(B)和總生存率(C)
NGS聯合流式細胞術用于AML患者的MRD監測
03
目前,流式細胞術在CR期AML患者復發預測方面的應用日益增多。研究者通過對340例患者進行NGS和流式細胞檢測,比較NGS非DTA突變和流式MRD陽性的一致性。結果顯示,69.1%的患者的檢測結果一致(30例檢測到殘留,205例未檢測到殘留),而64例患者僅NGS檢測到持續性非DTA突變,41例患者僅在流式細胞術中檢測到MRD陽性。在兩種方法檢測均為陽性的患者中,4年復發率為73.3%;僅測序的陽性患者中,4年復發率為52.3%;僅流式檢測陽性的患者中,4年復發率為49.8%。兩種方法檢測均陰性的患者中,4年復發率為26.7%(圖3)。因此,聯合使用NGS和流式細胞術進行MRD監測,對于AML患者的疾病復發、無復發生存和總生存率具有獨立的預后價值。
圖3 NGS和流式細胞術用于MRD監測的復發預測效能
小結
針對482例AML患者(初診與CR期)的靶向NGS檢測結果顯示,89.2%的患者至少攜帶一個基因突變,51.4%初診突變陽性的患者在CR期突變持續存在,其中DTA突變(DNMT3A、TET2和ASXL1基因)等位基因頻率較高,DTA突變常與年齡相關的克隆性造血相關,但CR期的DTA突變與4年復發率增加無關。因此,DTA突變不是AML患者合適的MRD監測指標,而非DTA突變的持續存在是AML患者復發和生存的獨立預后不良因素。NGS與流式細胞檢測聯合用于AML患者的MRD檢測有更顯著的預后預測價值。
參考文獻:
Jongen-Lavrencic M, Grob T, Hanekamp D, et al. Molecular minimal residual disease in acute myeloid leukemia[J]. New England Journal of Medicine, 2018, 378(13): 1189-1199.