

前
言
影響個體對藥物反應的因素很多,包括內源性因素如患者的年齡、性別、種族/民族、遺傳、疾病狀態和器官功能,其它生理變化如懷孕、哺乳,以及外源性因素如吸煙和飲食等。多項研究證實,基因變異是導致個體疾病表現和藥物反應多樣性的首要原因,這一觀點目前已得到廣泛認可。藥物基因組學(Pharmacogenomics, PGx)是從遺傳學角度解釋藥物作用個體差異的學科,通過分子生物學方法對個體的藥物相關基因進行檢測,臨床醫生可以根據患者的基因分型結果評估藥物的反應性,再結合患者的病情及實際經驗,“量體裁衣”的選擇適合個體的藥物種類及劑量,實現提高藥物療效、降低毒副作用的目的,同時能夠減輕患者的痛苦和經濟負擔,合理化配置醫療資源,減少不必要的浪費(見圖1)。
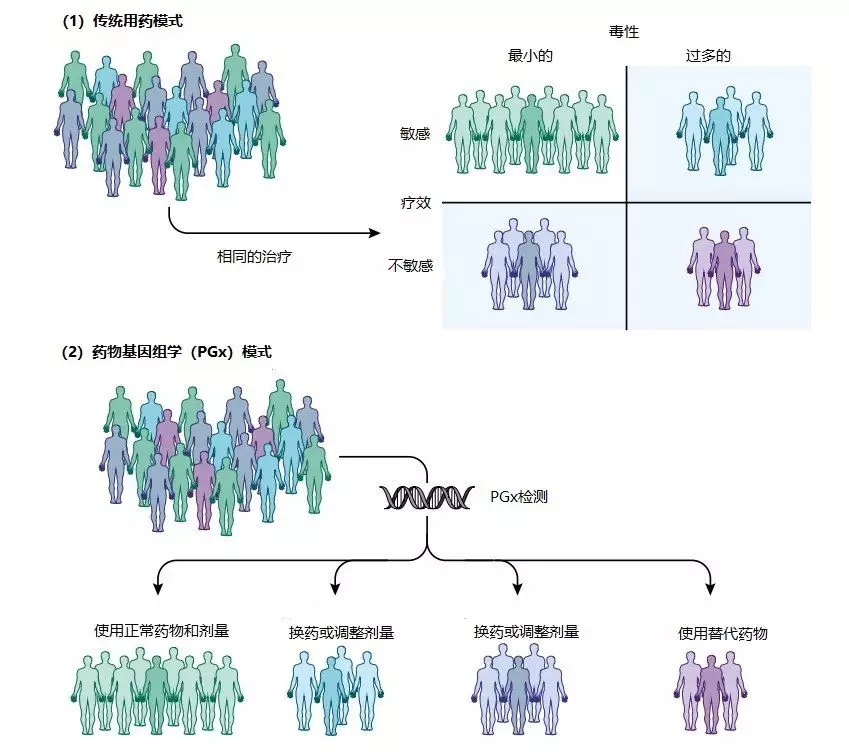
圖1 傳統的用藥模式與藥物基因組學(PGx)模式
腎病是一類嚴重影響人類健康的常見病,其病因復雜,可能發生腎性高血壓、腎性貧血、腎性骨病、水電解質紊亂、感染、心衰等并發癥,而患者尤其是老年患者往往同時存在心腦血管病、糖尿病等合并癥,患者個體差異大,普遍存在聯合用藥、診治較為復雜的特點,這也為腎病的精準治療提出了更高的要求。
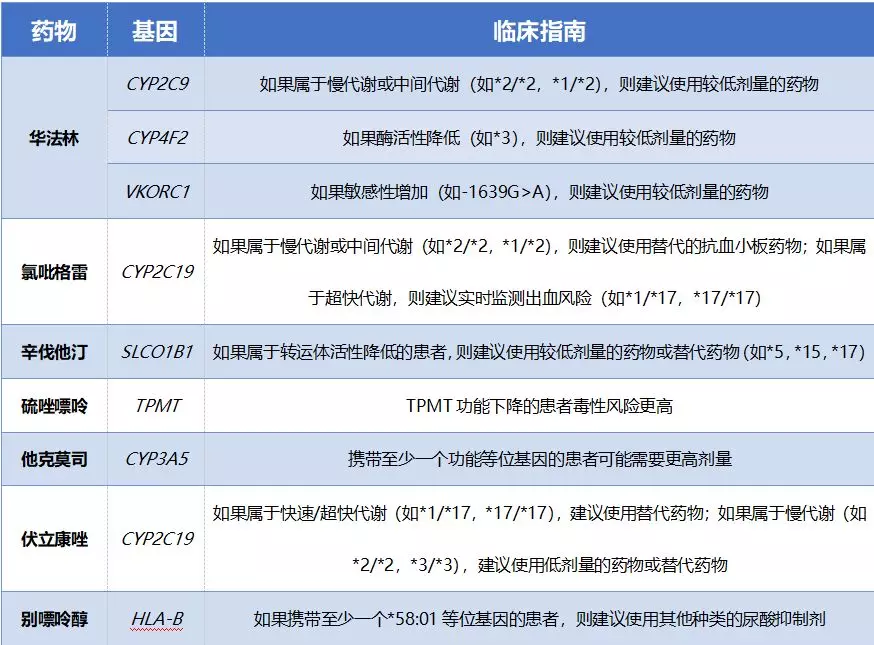
藥物體內代謝、轉運及藥物作用靶點相關基因的遺傳變異及其表達水平的變化可通過影響藥物在體內的濃度和敏感性,導致藥物反應性的個體差異。藥物基因組學是基因檢測指導腎病精準藥物治療的重要基礎,目前美國食品藥品監督管理局(Food and Drug Administration, FDA)、歐洲藥品管理局(European Medicines Agency, EMA)、藥物基因組學知識庫(www.pharmacgkb.org/)等為腎病常用的抗凝藥物、抗血小板藥物、他汀類藥物和移植用藥提供了較高級別證據的臨床推薦(見表1)。
心血管病用藥
心血管病是慢性腎病(chronic kidney disease, CKD)患者的主要并發癥。繼發于CKD的心血管病的特征是心臟重塑、動脈粥樣硬化和動脈硬化。目前心血管病的藥物基因組學研究和臨床應用是最為活躍的一個領域,華法林、氯吡格雷、辛伐他汀等藥物的基因檢測都已被納入FDA的藥品說明和相關指南中。
01 華法林
華法林是一種維生素K拮抗劑,通過抑制凝血因子II、VII、IX、X和蛋白C、S的形成來抑制凝血,其臨床療效和不良反應存在很大的個體差異,血藥濃度過高或敏感性增加可導致嚴重出血事件。因此,需要在數天至數周內頻繁監測國際標準化比率(INR),以確定華法林的最適劑量。腎功能受損的患者在使用華法林時,抗凝效果更差、大出血的發生風險更高,所以需要更低劑量的華法林。
華法林的藥代動力學和藥效學受多種基因型的影響。已知藥物代謝酶CYP2C9、CYP4F2以及影響藥物敏感性的VKORC1基因變異是影響華法林劑量的主要遺傳因素,臨床已用于預測達到最佳抗凝效果(INR)所需的華法林起始劑量。
02 氯吡格雷
抗血小板藥物(普拉格雷、替格瑞洛、氯吡格雷)適用于冠狀動脈支架置入術以及腎動脈支架植入術后的患者。由于這類藥物存在不同的出血、治療失敗和增加用藥成本的風險,缺乏有效的治療反應生物標志物成為其臨床應用的主要挑戰。
最常用的處方藥物氯吡格雷是一種前藥,需要經過CYP2C19酶代謝成活性物質才能發揮抗血小板聚集的作用。CYP2C19代謝酶活性降低的患者(慢代謝)體內活性代謝物生成減少,血小板抑制率降低。相反,CYP2C19活性增加的患者(快代謝和超快代謝)由于其氯吡格雷活性代謝物的生成增加,因此,理論上具有更高的血小板抑制率和出血風險。
03 他汀類
辛伐他汀、阿托伐他汀等他汀類藥物是常用的降膽固醇藥物,肌毒性是他汀類藥物罕見且最為嚴重的不良反應,可進一步發展為橫紋肌溶解癥。盡管大多數他汀類藥物的毒性風險較低,但大劑量(80mg)辛伐他汀的風險可能略高于其他他汀類藥物(36mg)。
有機陰離子轉運多肽 OATP1B1由SLCO1B1基因編碼,該基因第5號外顯子的c.521T>C(Val174Ala)多態性是亞洲人群中的主要遺傳變異,CC基因型個體OATP1B1對其底物的攝取能力顯著降低,使辛伐他汀、阿托伐他汀等藥物的血藥濃度升高,肌病和橫紋肌溶解癥的發生風險增加。因此,為了降低肌病等嚴重不良反應的發生風險,建議臨床根據SLCO1B1基因型選擇合適種類和劑量的他汀類藥物進行治療。
移植用藥
腎移植是慢性腎病5期(終末期)患者的首選治療方法,移植后用藥如硫唑嘌呤、他克莫司、伏立康唑等具有有效治療窗窄,且患者對藥物的反應差異大等特點。如前所述,遺傳因素是藥物反應個體差異的重要原因,因此,腎移植后用藥也是目前藥物基因組學臨床應用較多的一個領域。
01 硫唑嘌呤
硫唑嘌呤是移植后用于長期維持免疫抑制治療的抗代謝物,是腎移植患者降低成本的重要策略。硫唑嘌呤作為前體藥物在肝臟內經谷胱甘肽轉移酶轉化為6-巰基嘌呤(6-MP)。6-MP可經TPMT代謝為無活性的6-甲巰基嘌呤(6-MMP)。TPMT活性降低可增加巰嘌呤類藥物的造血系統毒性(嚴重的骨髓抑制)。
FDA已批準在硫唑嘌呤的藥品說明書中增加在用藥前進行TPMT基因多態性檢測的建議。CPIC建議TPMT酶活性低的個體在接受6-MP治療時減少用藥劑量,中間代謝型個體的起始劑量為常規劑量的30~70%,慢代謝型個體應減少至常規用藥劑量的1/10,或每周3次給予常規劑量的藥物,或考慮更換其他藥物,以避免發生嚴重的造血系統毒性。此外,TPMT活性極高的個體接受常規劑量的6-MP治療時可能達不到治療效果。
02 他克莫司
他克莫司是鈣調磷酸酶抑制劑,是移植后長期免疫抑制治療的基礎藥物。其臨床應用以常規治療的藥物監測為特點,治療窗窄,個體間血藥濃度差異大。器官移植患者應用他克莫司后血藥濃度偏低可導致急性排斥反應和藥物敏感性降低;血藥濃度偏高則容易發生腎毒性、神經毒性、糖尿病、高血脂癥、高血壓和胃腸道紊亂等不良反應。
CYP3A5在他克莫司的代謝中起重要作用,其活性降低可導致他克莫司的血藥濃度升高,不良反應增加。CPIC指南建議攜帶CYP3A5*3/*3基因型的移植患者減少他克莫司的用藥劑量,以避免發生藥物不良反應。
03 伏立康唑
伏立康唑是一種三唑類抗真菌藥物,用于腎移植和侵襲性真菌感染患者。與上述移植后用藥相似,伏立康唑的藥物反應個體差異性大,治療窗較窄,需要進行血藥濃度監測。
伏立康唑的代謝主要通過CYP2C19進行。CYP2C19 快代謝與慢代謝個體伏立康唑的血藥濃度存在顯著差異,慢代謝個體在應用常規劑量藥物時可能出現毒副反應,建議減少用藥劑量;在常規劑量治療時,若快代謝個體療效不佳或慢代謝個體出現毒副反應時均應考慮更換藥物。FDA批準的藥品說明書中指出應用伏立康唑前需檢測CYP2C19基因型,以確保用藥安全。
高尿酸用藥
高尿酸血癥是慢性腎病患者最常見的并發癥,是疾病進展的獨立危險因素。別嘌呤醇通常用于降低尿酸水平,該藥是造成藥物相關嚴重皮膚不良反應(severe cutaneous adverse reactions , SCARs)的主要原因之一,包括中毒性表皮壞死溶解和Steven Johnson綜合征。
藥物引起的嚴重皮膚不良反應的風險與主要組織相容性復合體(MHC)位點的HLA-B*58:01等位基因有關。HLA-B*58:01最初在東亞人群中發現,研究證實,該位點是別嘌呤醇嚴重皮膚反應的最大危險因素和特異性基因標志物。攜帶至少一個HLA-B*58:01等位基因的患者,使用別嘌呤醇發生嚴重皮膚不良反應的風險更高。CPIC指南建議,攜帶HLA-B*58:01等位基因的患者禁用別嘌呤醇。
參考文獻
[1]Johnson JA, et al. Clinical Pharmacogenetics Implementation Consortium (CPIC) guideline for pharmacogenetics-guided warfarin dosing. Clin Pharmacol Ther 102: 397–404, 2017.
[2] Scott SA, et al. Clinical Pharmacogenetics Implementation Consortium: Clinical Pharmacog- enetics Implementation Consortium guidelines for CYP2C19 genotype and clopidogrel therapy. Clin Pharmacol Ther 94: 317–323, 2013.
[3]Ramsey LB, et al. The clinical pharmacogenetics implementation consortium guideline for SLCO1B1 and simvastatin-induced myopathy. Clin Pharmacol Ther 96: 423–428, 2014.
[4]Relling MV, et al. Clinical Pharmacogenetics Implementation Consortium: Clinical Pharmaco- genetics Implementation Consortium guidelines for thiopurine methyltransferase genotype and thiopurine dosing. Clin Pharmacol Ther 89: 387–391, 2011.
[5]BirdwellKA, et al. Clinical Pharmacogenetics Implementation Consortium (CPIC) guidelines for CYP3A5 genotype and tacrolimus dosing. Clin Pharmacol Ther 98: 19–24, 2015.
[6]Moriyama B, et al. Clinical Pharmacogenetics Implementation Consortium (CPIC) guidelines for CYP2C19 and voriconazole therapy. Clin Pharmacol Ther 102: 45-51, 2017
[7]Hershfield MS, et al. Clinical Pharmacogenetics Implementation Consortium guidelines for human leukocyte antigen-B genotype and allopurinol dosing. Clin Pharmacol Ther 93: 153–158, 2013.
[8]Solomon M, et al. Clinical Pharmacogenomics Applications in Nephrology. Clin J Am Soc Nephrol 13:2018.
圖/文:醫學部
編 輯:市場部