

最近Nature Reviews | Genetics發表了一篇有關SNP與疾病風險評估的雄文(PMID: 29789686),為了幫助讀者理解這些科學上的概念,受『基因游俠』之邀,安塞斯生物的三位小伙伴對有關多基因與疾病風險的最新研究進行了整理,針對多基因風險分析在臨床決策和個人疾病風險評估中的價值為大家進行了詳細介紹:
在一些成年期發作的常見疾病的早期檢測和預防中,評估個體的疾病易感概率(風險預測)是臨床決策的核心。并且在雙方有效充分溝通的前提下,它可以成為個人健康管理的有力工具。目前對常見成年起病的復雜疾病臨床風險預測往往依賴于基本的統計特征(如年齡,性別和種族等),基本健康參數和生活方式(如體重指數,吸煙情況,飲酒和運動習慣等),疾病發作密切相關的臨床風險因素評估(如血壓和可預示疾病進程的血液生化指標、生物標志物等),環境因素的暴露情況(如空氣污染、重金屬及其他環境毒素),和家族史。在這些因素中,遺傳因素明顯不是作為常規手段,而是僅僅在家族史明確的情況下,用于對某些常見成年發作疾病進行個體風險評估。

疾病的早期檢測,預防和干預是促進人類健康的核心目標。同時,遺傳風險評估,無論從何種意圖和目的來看,都是常見復雜疾病遺傳因素風險評估的最早可測量的因素。 因此,從理論上講,遺傳分析是健康管理的有效組成部分。事實上,近期研究表明,我們對某些疾病遺傳機制的了解已可滿足建立多基因風險評分(PRS)計算體系的需求,進而通過多基因風險分析為個人健康和臨床應用提供保證。
在此,我們回顧了遺傳風險分析對常見成人發病的復雜疾病的效用,重點關注導致發達國家人口死亡疾病的主要遺傳因素:如老年癡呆癥、癌癥(乳腺癌和前列腺癌)、冠心病和2型糖尿病。在此情況下,最近的研究將多基因風險預測與可干預的臨床結局聯系起來,包括預防干預措施和篩查的優化,疾病發病年齡的預測,受益于生活方式的改變,以及家族疾病風險的改變導致臨床決策的變化。我們首先概述了常見疾病的遺傳結構,然后,我們描述了遺傳風險因素如何結合起來產生PRSs,并回顧近期研究,證明了PRSs對疾病風險分層的作用,以及它們對早期疾病檢測、預防、治療干預和/或生命規劃的影響。我們描述了PRSs的一些局限性,以及在臨床和個人實用性方面的障礙,并為提高PRSs的預測能力、普遍性和實用性方面提供了潛在的未來發展方向。
常見病的遺傳性
疾病風險的基本組成通常分為遺傳易感因素、環境暴露因素和生活方式因素。在人群中,遺傳易感性對疾病易感性的相對貢獻可以通過疾病在該人群中的遺傳能力來量化。可遺傳性本身可以用幾種方式來定義,從數量遺傳學的角度來看—特別是當它與全基因組關聯研究(GWAS)中遺傳性的缺乏有關時—通常被定義為一個種群中表型變異的比例,可以用遺傳變異來解釋。這種可遺傳性的定義經常被錯誤地解釋為多少基因因素導致了任何一個個體的疾病發生。

遺傳性在人群和個體疾病風險中的解釋。雖然遺傳力與人口水平遺傳風險分層的理論極限有關,但它并不直接與個體遺傳信息的效用相關。為了進一步說明這一區別,將BRCA1和BRCA2檢測作為遺傳風險信息效用的一個公認的例子。在遠親后代人群中,BRCA1和BRCA2基因的突變攜帶率遠小于1%。因此,在人群水平上,由BRCA1和BRCA2突變引起的乳腺癌的遺傳力和總發病率都很低,約占所有乳腺癌病例的5%。然而,與普通人群中12%的終生風險相比,BRCA1和BRCA2的致病突變導致患乳腺癌的終生風險分別為65%和45%。換句話說,盡管BRCA1和BRCA2變異解釋總的遺傳力較低,但BRCA1和BRCA2檢測可以鑒別那些絕對患病風險明顯高于普通人群平均水平的一組個體。這些高危個體受益于量身定制的健康管理策略,其中可能包括更頻繁的疾病篩查或更激進的干預措施。群體中對于遺傳性的解釋和風險傳遞給個體之間的區別等同于大量基因變異,這些變異累積可能無法解釋遺傳性的很大一部分,但可能向那些基因組富含風險等位基因的個體傳達臨床上有意義的風險,尤其是考慮與其他臨床危險因素結合使用。
對于一些常見的成人疾病,攜帶大量風險等位基因的高風險人群(約占總人群10-20%)的多基因風險與常用臨床風險因素所代表的風險相當(圖1)。個體攜帶的基因變異和該個體的絕對患病風險之間的關系由目標疾病的潛在遺傳結構決定,包括影響疾病風險的基因變異的數量和頻率,每種基因變異對疾病易感性的影響程度,以及疾病在普通人群中的發病率。
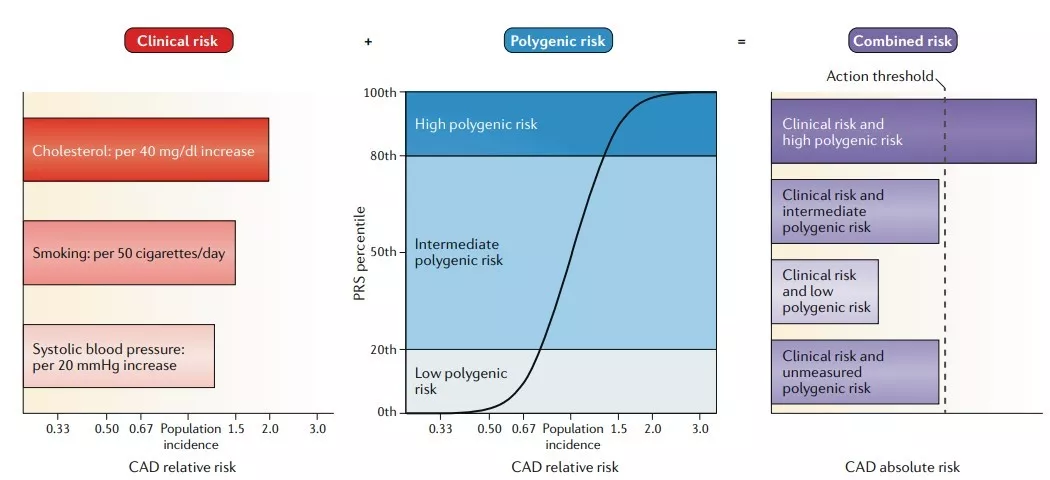
圖1 臨床風險加基因風險等于總風險,CAD代表冠狀動脈疾病
常見疾病的遺傳結構。盡管最近的大規模遺傳研究和先進的分析技術可以表明最合理的結構,但大多數常見的成人疾病的遺傳結構還未得到充分的研究。遺傳結構通常被歸類為單基因和多基因,這意味著一個或多個基因的紊亂分別導致了個體中疾病的發生。對于常見的成人疾病,這種二元分類是一種源于現有的技術和研究設計的歷史產物,最適合于檢測罕見的高風險(單基因的;基于家族的連鎖分析)與普通低風險(多基因的;通過GWAS)的遺傳風險位點。
家族性高膽固醇血癥引起的冠狀動脈疾病,癌癥的DNA修復缺陷,阿爾茨海默病中淀粉樣蛋白前體蛋白加工缺陷和青少年患者2型糖尿病。與BRCA1和BRCA2的例子一樣,對這些疾病的高風險變異進行基因檢測(通常根據家族史),可以確定一部分高風險人群,如果有相關干預措施,他們可以從遺傳風險狀態中獲益。對于絕大多數沒有家族史(非家族性疾病)證據的人來說,由于不準確的家族病史、新生突變、家族規模小或性別特定的遺傳,可能會掩蓋高危變異的存在;然而,遺傳風險的相關來源通常來自更復雜的遺傳結構組成部分。
多基因疾病的易感性。現有的證據表明,許多常見的成人疾病的絕大多數剩余遺傳性是由許多常見(MAF>5%)和低頻(MAF>0.5%和<5%)的基因變異介導的,這些變異可以各自產生小的影響,其中大部分可以通過全基因組基因分型得到。應該指出的是,遺傳性統計模型是一個爭論激烈而積極的話題,在本綜述中無法完全解決,我們將讀者引向新發表的文獻。本綜述中的遺傳性估計報告與最大的歐洲血統評估人群有關,應謹慎解釋。然而,最近大規模gwas(>100,000個人)的結果和許多常見成人疾病的測序工作繼續拓展我們對與疾病相關基因座數量的認識,其相關性與遺傳模型一致,這表明一個無窮小或是全基因組的遺傳模型。在該模型中,非家族性疾病風險主要由大量具有較小累加效應的常見遺傳變異(效應大小的近似范圍(OR值)定義為小:1.0-1.5,中等:> 1.5,和中間:> 3.0),以及相對貢獻較小的家族性疾病已知相關基因中那些中等效應的罕見變異共同驅動而成的。

例如,最近一項關于冠狀動脈疾病的大規模綜合性(包括插補)GWAS研究發現,大多數疾病的遺傳性可能可以用小劑量效應的常見變異來解釋。幾乎未發現具有中等或較大影響的低頻變異(OR值> 1.5),盡管該研究能夠很好地檢測出大多數此類關聯——插補可以驗證絕大多數(~90%)但不是所有的低頻變體。同樣,最近一項針對2型糖尿病的大規模測序研究發現,檢測到的風險位點的頻譜與常見的多基因疾病模型一致,其中大部分遺傳性是由小效應的常見變異造成的。同樣,盡管能夠很好地檢測到這種關聯,但幾乎未發現具有中等或較大影響的低頻風險變異。同時,在已知與家族性糖尿病相關的基因中觀察到富含中等效應的罕見變異對2型糖尿病易感性的影響。類似的,最近一項針對乳腺癌的大規模綜合GWAS發現,41%的家族性乳腺癌的相對風險可以通過基因分型和插補捕獲的遺傳變異來解釋,同樣,盡管有足夠的能力檢測到這種關聯,但仍未檢測到中等影響的低頻變異。眾所周知,與家族乳腺癌相關的基因中具有中等效應的罕見變異在乳腺癌的發病中起到重要的作用。在前列腺癌中也觀察到類似的遺傳結構。最后,最近的研究表明,約70%至90%的晚發性阿爾茨海默病遺傳性可以通過GWAS中由基因分型和插補捕獲的遺傳變異進行解釋,而外顯子芯片研究發現很少有證據表明低頻風險變異具有中等或更大的影響。此外,對聚集晚期老年癡呆癥的家庭進行的測序研究,已經確定了具有中度影響的罕見變異。
因此,來自統計模型的預測和綜合基因組研究的實證結果均支持了這樣的結論:許多常見的成人疾病的遺傳結構由家族性結構和非家族性結構的疾病組成。其中,家族性結構的疾病占疾病發病率的1-10%,與導致家族性疾病的一小組基因中高外顯率的罕見變異相關;而非家族性疾病主要由分布在整個基因組中的小效應常見變異的累積所致,并結合那些已知能引起家族性疾病的基因中具有中等效應的罕見變異。觀察到的多基因結構與假設的遺傳結構一致,這種結構推動了GWAS的設計—“常見疾病,常見變異”假說, 假定造成特定人群中大多數疾病風險的遺傳變異在多個人群中共享。迄今為止,研究結果僅僅表明許多變異的效果比最初預期的要小得多(方框1)。因為任何一種常見的基因變異都無法對疾病風險進行有效的分層,研究人員試圖同時利用多種變異來進行風險預測。
多基因風險評分的發展
在回顧那些支持多基因風險預測效用的證據之前,我們簡要地描述PRS本身的發展和評估。有關考慮PRS發展的詳細討論,特別是需要對臨床使用的PRS進行適當校準,請參閱Chatterjee等人的深入研究。簡而言之,PRS常被計算為個體攜帶的風險等位基因數量的加權總和,其中風險等位基因及其權重由基因座定義及其測量的效應取決于全基因組關聯研究檢測。在某些情況下,比全基因組統計意義更低的閾值被用來提高或估計總體可預測性,通常以犧牲普遍性為代價。在其他情況下,可以重新校準模型來說明通常在發現群組中被夸大的效應量的偏差,以解釋每個疾病相關基因座內的多個連鎖變體,以重新估計感興趣的亞表型的效應大小,或調整可能影響模型普遍性的種族或人口統計學因素。然而,最常見的方法是在文獻中報道的易感基因座上風險總和的簡單方法,但可能沒有針對預測能力進行優化。對PRS效用的評估通常通過確定其是否可以結合臨床風險因素來將人群劃分為絕對風險的差異程度足夠大的類別來驅動臨床或個人決策(圖1)。
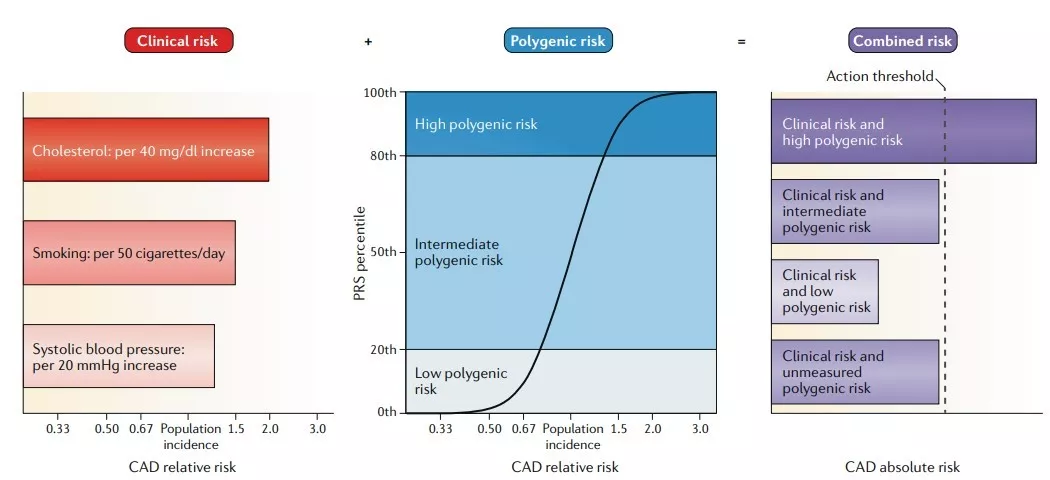
圖1
從歷史上看,基于GWAS的遺傳風險評估的應用已經根據其全面區分患病和非患病個體的能力進行了可能不恰當的評估,通常通過受試者工作特征曲線下的面積(AUC)來量化,畫一個真陽性率(敏感性)對假陽性率(特異性)的圖。AUC相當于患病個體的預測風險高于無病個體的預測風險的總體概率;它沒有向任何單一個體或群體提供任何關于預測的絕對風險的信息。換句話說,AUC是一種最適合于診斷測試的人群水平指標,其主要目的是將患病和非患病個體分離。然而,遺傳風險信息的相關用例是預后,預測特定結果(例如疾病的發作)在每個個體或群體中發生的可能性(圖2)。
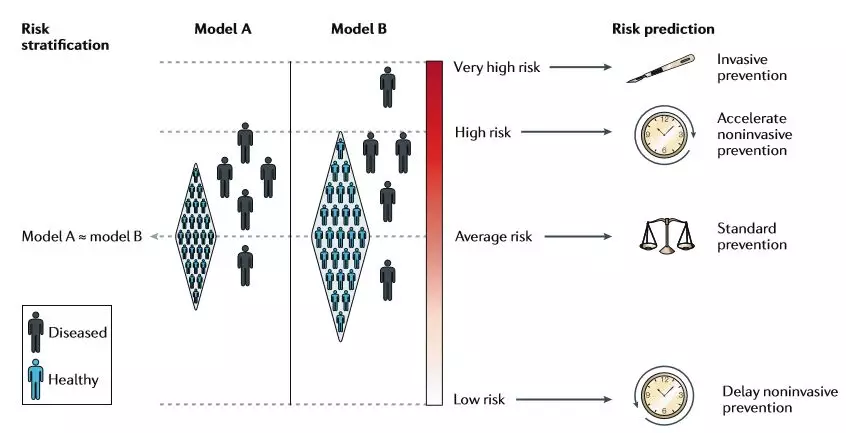
圖2 風險分層與風險預測的對比,兩種評估模型B要優于A
雖然多基因風險評估的最終目標可能是通過完整核算每個個體的疾病遺傳易感性而對整個人群進行全面分層,但更現實和實際的目標是根據遺傳因素與臨床風險因素的結合確定疾病風險高的一部分人群。返回到BRCA1和BRCA2檢測示例來說明這種差異。我們不認為僅通過BRCA1和BRCA2檢測能夠全面地將所有女性的乳腺癌遺傳易感性分類,我們也不期望BRCA1和BRCA2檢測能夠完全識別出全部的乳腺癌遺傳風險較高的女性。相反,我們期望BRCA1和BRCA2測試能夠識別出高風險女性的一部分,當然一些BRCA1或BRCA2突變檢測呈陰性的女性由于其他未檢測到的遺傳因素而可能具有較高的遺傳風險。我們不排除某些特殊情況下,由于一些無法衡量的保護性遺傳因素,一些BRCA1或BRCA2突變陽性的女性實際上處于平均或低遺傳風險。
同樣,PRSs的直接效用應該根據多基因風險檢測“陽性”個體的概率風險來判斷。個人層面的PRS值通常用于根據百分位數臨界值(即前1%,前10%等)將人群分為不同的風險等級,這就導致了每層的個體被分配了不同程度的概率風險。請注意,在每一層的個體中,風險并不是精確定義的,就像每個BRCA1或BRCA2陽性個體的風險都沒有精確定義一樣。
將PRS檢測考慮為陽性的閾值取決于傳遞給位于PRS層級界限上的個體的疾病風險概率水平,通常與其他臨床風險因素所傳遞的風險相結合,和與預期干預相關的風險和收益之間的平衡(圖1)。一般來說,如下所述,醫學界已經確定了適當的風險與利益閾值證明某些醫療干預措施的合理性—干預措施的侵入性或風險性越大,干預措施必須減輕的絕對風險水平越高,以證明其干預措施應用的合理性。
多基因風險評分的效用
我們可以基于三種主要的干預措施對PRS效用進行大致分類:基于PRS的治療干預(PRS在治療或預防疾病的干預措施選擇中所起的作用); 基于PRS的疾病篩查(PRS在決策和疾病篩查的解釋中所起的作用); 和基于PRS的生活規劃(即使在沒有可提供的預防措施的情況下PRS可提供的個人效用)。PRS的效用在很大程度上取決于疾病特異性和干預特異性風險以及益處之間相當復雜的相互作用,使得普及變得困難。因此,我們回到關于發達國家中主要的遺傳性死亡原因的例子,以回顧支持PRS在這些干預類別中的作用的證據(圖3)。
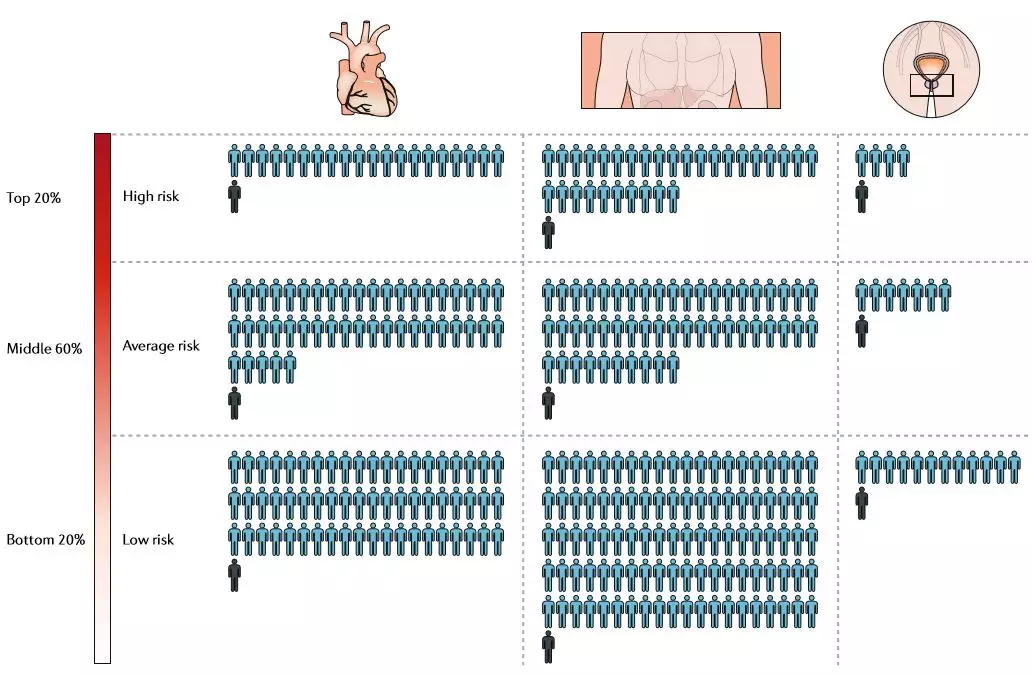
圖3 多基因風險評分等級的風險和收益
基于PRS的治療干預。對疾病的個體化管理是精準醫學理念的核心,通常會采用遺傳因素來實現個性化醫療保健。最近關于冠狀動脈疾病PRSs與預防性使用降膽固醇療法的研究證實了PRSs在優先化治療干預方面的潛在效用。美國預防服務工作組指出,目前的指南,建議年齡在40到75歲之間有風險的人群開始使用低劑量至中等劑量的他汀類藥物預防首次心臟病發作(一級預防),風險人群包括至少一個心血管不良事件(肥胖,糖尿病,高血壓或吸煙)的風險因素和10年心臟不良事件的絕對風險> 10%,或10年心臟不良事件絕對風險為7.5-10%。在這種情況下,通過考慮他汀類藥物療法的潛在危害與益處來做出最終決定。然而,他汀類藥物的使用并非沒有爭議。作為心臟病發作的一級預防,服用他汀類藥物5年的100人中只有不到2人避免了心臟病發作或中風,而100人中有1人因治療而患上糖尿病。其他專業學會推薦了替代指南,所有這些都包含了某種形式的臨床風險計算,眾所周知,這種指導方法高估了絕對風險。這種不確定性需要個性化的選擇來開始終生的他汀類藥物治療——這種不確定性已被證明可以通過使用冠狀動脈疾病PRS來部分解決。
盡管冠狀動脈疾病PRS并未顯著改善一般人群心臟病發作風險的整體分層,但結合臨床風險評估,PRS可能會修改某些個體的預估風險,使其綜合風險達到或高于推薦開始進行他汀類藥物治療的風險(圖1)。為此,大量研究表明,冠狀動脈疾病PRS是有效的,不需要考慮家族病史,可用于鑒定一些從開始使用他汀類藥物治療中獲益更多的高危人群。 Mega等和Natarajan等表明,在冠狀動脈疾病遺傳風險最高的五分之一患者中,冠狀動脈不良事件的風險(風險比)增加約30%;一旦開始他汀類藥物治療進行一級預防,這些患者的心臟病發作或冠狀動脈疾病相關死亡的10年風險相對風險降低約45%。中度多基因風險個體(60%位于五分之二至五分之四風險中的個體)的結果不同,其相對風險降低約25%,而遺傳風險最低的五分之一的個體沒有或幾乎沒有統計學益處。同樣地,Tikkanen 等和Ripatti 等研究顯示,冠狀動脈疾病PRS導致約12%的個體從總體中等風險類別重新分類為高風險類別,從而轉化為更強的他汀類藥物使用建議。此外,當他們被告知有冠狀動脈疾病的遺傳風險時,遺傳風險較高的個體更有可能開始并堅持他汀類藥物治療。最后,新發表的文獻表明,全基因組PRS可以識別出風險增加400%的前2.5%的個體,這相當于與家族性高膽固醇血癥相關的不良冠狀動脈事件風險,這將導致積極的降膽固醇治療建議。
基于PRS的疾病篩查。研究結果也證實了PRSs在癌癥疾病篩查中的應用。美國預防服務工作組指出,目前的指導方針建議對50歲以上的婦女開始兩年一次的乳房x光檢查,并考慮到在40歲至49歲之間開始進行乳房x光檢查的個人風險因素。這一基于年齡的標準是由不同年齡點乳腺癌的平均年齡風險和假陽性乳房x光檢查結果造成的損害風險之間的平衡來定義的。基于這一風險-收益閾值,乳腺癌PRS結合已知的臨床風險因素,發現有16%的人可以在40歲時做出明智的決定開始篩查,因為他們的風險超過了平均50歲的風險。另外,32%的人可能會推遲篩查,因為他們50歲時的風險低于平均40歲時的風險。在結直腸癌中也有類似的結果,在這種情況下,基于PRS的推薦建議PRS最高的百分之十的個體在42歲,而PRS最低的百分之十的個體在52歲時進行結腸鏡檢查。
PRSs還可以幫助解釋高假陽性率的篩查試驗,其中前列腺癌篩查是最臭名昭著的。美國預防服務工作組建議不要進行前列腺特異性抗原(PSA)篩查,因為對良性疾病的誤報和過度治療所造成的危害大于其益處。前列腺癌是相當普遍的疾病,九分之一的男性在其一生中都會患這種疾病,這使得這個建議變得復雜。然而,侵襲性疾病導致的死亡并不常見,約占被診斷為前列腺癌的男性的1%。盡管大多數前列腺癌是良性的,前列腺癌仍然是男性癌癥死亡的第二大原因,而且即使最初發現的時候是低風險疾病,往往也會發展成需要治療的疾病。前列腺癌PRS已被證明有助于識別疾病風險顯著升高的男性,他們從PSA檢測中獲得更大的風險 - 收益平衡。具體來說,通過PSA測試檢測侵襲性前列腺癌的陽性預測值在遺傳風險最高的5%人群中約為25%,而在普通人群中約為12.5%。PRS評分在前50%的個體占所有侵襲性前列腺癌病例的76%,前20%的個體占42%。重要的是,前列腺癌PRS并不特定于侵襲性疾病,因此其用于優先PSA篩查的用途僅解決了假陽性PSA檢測的問題,而不是過度治療良性疾病。使用額外的臨床風險因素和作為平衡競爭的個體的健康風險的積極監測計劃可能有助于確定治療是否必要。因此,PRS有可能優先為前列腺癌高危人群進行篩查,并對陽性檢測后采取的行動進行適當的咨詢。
基于PRS的生活規劃。最后,即使在缺乏預防性篩查和治療干預的情況下,PRSs也可能有價值。對于冠狀動脈疾病,遺傳風險最高的五分之一人群可以通過保持最佳的生活方式習慣來抵消大部分的風險,從而將總體患病風險降低近一半。對于乳腺癌,如果遺傳風險最高的十分之一的女性優先選擇健康的生活方式,估計可避免20%所有可預防的乳腺癌病例的發生。從理論上講,讓高危人群清楚地了解疾病易感性的知識,強調健康行為的益處,將是推動和維持行為改變的眾多有效工具之一。阿爾茨海默病是一個更有趣的案例,因為關于生活方式的選擇是否可以減輕阿爾茨海默病的發作有一些爭論。阿爾茨海默病的PRS最近被證明能夠顯著地按照患者發病的平均年齡進行分層。處于前四分位的PRS患者平均發病年齡為75歲,而處于后四分位的患者平均發病年齡為95歲。阿爾茨海默病受一種強烈的遺傳風險因素——APOE狀態的影響。然而,即使通過將分析限制于對APOE-ε3等位基因純合的個體來消除該因子的影響,疾病發作的平均年齡的差異在遺傳風險的頂部與底部十分位數中仍為10年。盡管健康行為的采用可能不會影響阿爾茨海默病的風險,但這些信息可以為財務、法律和護理規劃提供信息。
展望
PRS效用的障礙和警告。基于PRSs的遺傳風險評估開始顯示出其可識別出可能受益于預防性行動的部分人群的能力。然而,將PRSs應用于實踐仍然存在許多科學、臨床和社會障礙。雖然我們將高風險變異的效用與累積多基因風險評估進行了比較,但通過多基因確定個體水平風險評估與家族性疾病遺傳檢測確定的高風險個體相比存在更大的不確定性。這種不確定性的一個主要組成部分是由于高風險變異的詢問通常涉及直接因果變異的鑒定,而多基因風險評估可能包含與因果遺傳因子不完全相關的變異。這導致在評估整合進PRS中的每個個體變異相關的效應量時存在一些不確定性,并且降低了在所研究的群體之外的群體中進行PRS風險評估的普遍性。這個問題在從歐洲血統人群(大多數GWAS所應用的人口)到非洲血統人群的風險評估可轉移性方面最為明顯。
人們很容易將缺失的遺傳性(遺傳風險的未知成分)作為多基因風險估計特有的另一個不確定因素。然而,這一論點依賴于確定性家族性疾病變異與多基因風險概率之間一個看似錯誤的二分法。事實上,最近的證據表明,家族性突變患病風險也是有概率范圍的,也受多基因風險的影響。例如,BRCA1或BRCA2突變攜帶者乳腺癌的絕對風險受已知多基因危險因素的顯著影響,其效應量大小與BRCA1或BRCA2突變攜帶者和非攜帶者一致但略小。已知的多基因風險因子的累積影響足以改變BRCA1和BRCA2突變攜帶者的總體絕對風險水平,從而改變乳房x射線篩查建議。例如,位于乳腺癌風險最低與最高PRS十分位數的BRCA1攜帶者在50歲時患乳腺癌的絕對風險分別為21%和39%,而在年齡80歲時患乳腺癌的風險為56%和75%。同樣,BRCA1攜帶者在80歲時患前列腺癌的風險在7%到26%之間,BRCA2攜帶者在前列腺癌PRS的第5百分位數和第95百分位數之間的風險在19%到61%之間。此外,還有一些已知的與多基因疾病風險無關的多基因因子專門修飾BRCA1和BRCA2突變攜帶者的風險。同樣,家族性高膽固醇血癥患者的多基因風險也會顯著改變其心臟病發作的風險。因此,對于通過測量的高風險變異或多基因因素確定的高風險個體來說,由于未經測量的遺傳因素而導致的估計風險的不確定性水平可能不會更大。由高風險變異鑒定的高風險個體的總體絕對風險可能遠遠大于多基因因素所賦予的風險。然而,這只是根據可用干預措施的風險與利益的平衡,轉化為可以對這些個體做出的不同建議。然而,應該注意的是,對于家族性與多基因遺傳易感性的疾病,疾病表現,嚴重程度和可用的治療干預都可能存在差異。
PRS效用的其他障礙包括醫生和公共教育對多基因風險的解釋,特別是在理解各種動態風險指標方面。最近對運動能力,飲食建議和其他方面未經證實的遺傳檢測的趨勢可能使非專家難以區別于上述經驗證的方法。由于早期的商業化努力,醫生和公眾輿論可能會對那些有效用的檢測產生負面偏見。缺乏信任可能會影響PRS的使用方式。例如,為了通過使用PRS提高臨床實踐的效力和效率,較低的多基因和臨床風險的個體及其醫生可能需要延遲篩查或決定不采取治療干預,而與由于總體風險增加而應該加速篩查和治療干預的推薦相比,這種建議更具挑戰性。此外,必須制定有效地向醫生和個人傳達風險信息的策略,并且可以針對不同的目標受眾進行定制,特別是當其目的是推動預防行為的采用時。PRS信息以焦慮,宿命論思想或采用虛假安全感的形式產生的對社會心理學的不良影響必須被視為這種傳播策略的一部分。這些擔憂已被證明是輕微的86-88,但隨著模型的不斷改進到能夠傳達相當高風險水平的程度,那時的PRS結果可能會變得更加驚人。隨著PRS評估的不斷發展,需要加強對基因歧視的保護,以鼓勵采用這種方法。最后,應進行大規模的前瞻性研究來檢驗PRS的臨床效用。
未來發展方向。 PRS風險評估的實用性目前受其簡單性的限制。未來的發展可以考慮多種研究方向,以提高其全面性,減少不確定性并提高普遍性。對于風險溝通,開發方法以在個體水平上傳達與遺傳風險評估相關的不確定性將是有用的,尤其是包含由測量和未測量因素產生的不確定性的方法。例如,統計模型17可用于預測尚未鑒定的GWAS位點的預期等位基因頻率和效應量,以通過包括這些當前未測量因子的PRS估計個體的未來遺傳風險的分布。重要的是,我們預計由于未來的基因發現而導致重新分類的風險不大,特別是考慮到缺乏中等或較大影響的低頻風險變異。對于個人層面的決策,量化這種不確定性將是一個需要考慮的重要組成部分。為了提高全面性和減少不確定性,需要綜合家族風險和多基因風險的風險評估。這將有助于減輕家族風險或多基因檢測陰性可能傳達的虛假安全感相關的一些但并非所有的問題,并且將改善家族風險和多基因遺傳檢測方式。通過使用全基因組預測模型而不是僅限于GWAS顯著性變異的模型,也可以提高全面性,盡管這也會導致對普遍性的進一步擔憂。最終,應該開發出更加動態的方法來估計個體遺傳變異相關的效應,給出個體的遺傳,人口統計學和臨床風險因素背景。一種解決方案是為每種疾病開發多個模型,以適應不同的使用情況——甚至在測量同一事件在不同情況下的風險時也是如此。例如,人口統計學,生活方式和臨床風險因素的預后價值的平衡在整個生命周期中都會發生變化,應予以考慮。最后,鑒于機器學習和人工智能的進步,通過這些技術擴展PRS模型可能是解決遺傳因素的變化影響及其與其他預后因素相互作用的更實際的解決方案,盡管這些技術用于遺傳風險預測與其自身的問題相關聯,包括有效訓練這些模型所需的大規模數據集的大小以及解釋黑匣子解決方案的困難。最終,我們認為,我們知識的積累和公共興趣的爆炸式增長使我們達到了一個臨界點,此時應該進行大規模研究來證明多基因風險評估的效用。